B-breve M-16V
Er probiotika som eksempelvis bifidobakterier trygt å bruke til spedbarn? Hvis du ikke er overbevist, les studiene på sikkerhet og seleksjonskriterier her.
Er probiotika som eksempelvis bifidobakterier trygt å bruke til spedbarn? Hvis du ikke er overbevist, les studiene på sikkerhet og seleksjonskriterier her.
Bifidobakterier er de aller mest vanlige bakteriene i tarmen hos det friske, ammede spedbarnet. Ulike bakteriestammer produserer metabolitter som kortkjedede fettsyrer i forskjellige volumer, og kommuniserer derfor forskjellig med f.eks. spedbarnets immunsystem. Immunstøtten fra disse naturlig gode bakteriene er ulik mellom stammetype og volum; det er derfor vi har valgt Bifidobacterium.
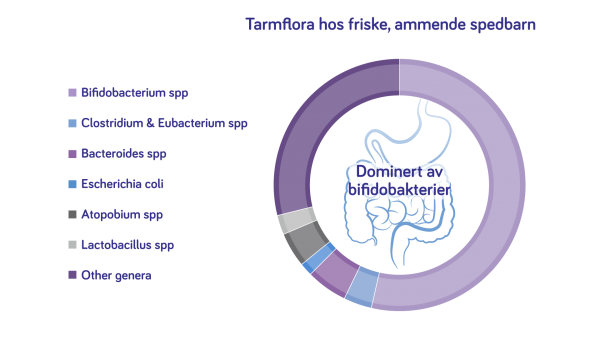
Figur 1: Utviklet av Nutricia (3-5)
B. breve er den vanligste Bifidobacterium typen funnet i morsmelk6, og breve og longum er de vanligste Bifidobacterium funnet i tarmfloraen til ammede spedbarn.7
B. breve M-16V ble valgt blant 400 ulike stammer og er støttet av 17 kliniske studier siden 1994. At dette ikke dreier seg om noen ny, ukjent type er helt klart. B. breve M-16V har også blitt studert i forskjellige allergipopulasjoner.
Preklinisk forskning har vist at Bifidobacterium breve M-16V er den mest lovende stammen for å redusere allergiske symptomer, og har vist seg å ha anti-allergene egenskaper.12
Bifidobacterium er blant de første kolonisatorene i tarmen til nyfødte, friske ammende spedbarn. B. breve-stammen (ved siden av B. longum og B. bifidum) er rikelig tilstede i tarmfloraen hos friske spedbarn, og har vært gjenstand for genetiske studier med sikte på å avdekke de molekylære mekanismene som ligger til grunn for den gunstige aktiviteten.
B. breve kan også ha en innvirkning på immunmodning og tarmbarriere 13, støtte spedbarnet mot patogenkolonisering og utvikle tarmbarriere14 (prekliniske data), og forbedre vaksinasjonsresponsen.15
Sikkerheten til B. breve M-16V i spedbarnsernæring er godt dokumentert med en rekke studier16-20og sikkerheten har dessuten blitt demonstrert i toksisitetsstudier in vivo.21
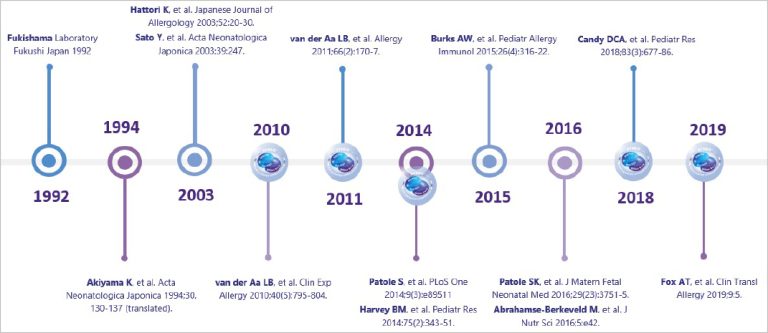
Figur 2: Oversikt utviklet av Nutricia; eksempler inkl. ikke uttømmende av sikkerheten til B. breve i kliniske studier.
I mer enn 40 år har Nutricia vært en pioner innenfor ernæringsløsninger for kumelkallergi, for å være med å støtte barnets helse og livskvalitet tidlig i livet.
Les mer2–3 % av alle barn rammes av melkeallergi. Nesten alle får symptomer i løpet av det første leveåret. Allergien gir seg ofte til kjenne når barnet begynner å få grøt eller spesialernæring som inneholder kumelk.
Les merSymptomer på kumelkeallergi kan vises på mange forskjellige måter og store variasjoner mellom forskjellige barn. Dette kan noen ganger bidra til å forsinke et melkeallergisk barns korrekte diagnose.
Les merKumelkproteinallergi er klassifisert som enten IgE-mediert eller ikke-IgE-mediert, og diagnosen er ikke alltid like lett å stille.
Les merDin anbefaling kan gjøre en forskjell for spedbarn med kumelkallergi. Få en oversikt over næringssammensetning og fordelene
Les mer
Neocate Junior er et komplett, hypoallergent, aminosyrebasert ernæringsprodukt til kostbehandling av barn fra 1-10 år med kumelkallergi, multimatvareallergi og andre tilstander der en elementalkost er indikert.
Les mer
Komplett, aminosyrebasert ernæringsprodukt til kostbehandling av spedbarn (0-1 år) med kumelkallergi, multimatvareallergi og andre tilstander hvor en elementalkost er anbefalt.
Les mer
Aminosyrebasert næringstilskudd til kostbehandling av barn med kumelkproteinallergi, multimatvareallergi og andre indikasjoner hvor en elementalkost er anbefalt. Neocate Spoon utblandet med vann får en passende konsistens for skje og er velegnet for kumelkallergiske barn som skal tilvennes fast føde. Til barn og spedbarn fra 6 måneders alder.
Les mer
Pepticate er en mysebasert, høygradig hydrolysat til kostbehandling av barn (0-1 år) med kumelkallergi. Inneholder 0,66 kcal/ml.
Les mer
Pepticate PLUS er en mysebasert, høygradig hydrolysert spesialnæring til kostbehandling av barn (fra 6 måneder) med kumelkallergi. Inneholder 0,68 kcal/ml.
Les mer